
介绍
欧洲药典的大多数专论都采用液相色谱法紫外检测器进行有关物质的测定[1]。这些试验用于测定产物或合成副产物或降解物等杂质。
最近的专论区分了特定杂质和非特定杂质[2],特定杂质存在单独的接受标准,因此有必要在色谱系统中准确的鉴定它们。这里的鉴定,不要和阐明结构的鉴别,意义弄混淆,更好的表述应该是“峰鉴别”。后者最好使用化学标准物质(CRS)进行,由于不能获得足够量的单个杂质,亦可使用该专论物质(即待测物,以下称为供试品)和特定杂质的混合物或者是没有加入供试品的杂质混合物进行[3]。
专论中不仅提供了在色谱系统中鉴别这些杂质的方法,同时描述了如何对其定量。
定量
样品中杂质的量通常使用“外标法”测定,但也采用面积归一化法。
当使用外标法时,优先的选择是使用单个杂质来制备含有这些杂质的标准溶液,标准溶液的浓度应在特定杂质的限度范围内,即相对于供试液的浓度0.1~1.0%之间。
然而,如上所述,这些杂质通常不能获得足够量作为单独的对照品并建立标准。这种情况下,可以将供试液的稀释液,例如1/100供试液,作为测定样品中这些杂质量的对照。当供试品与杂质具有相似的吸收曲线时,即在选定的波长下检测器的响应是相似的,可以选择此法。另一方面,不同的吸收曲线可能会导致在所选波长处响应值有明显的不同。因此,在方法学验证中,测定特定杂质的响应因子的必要的。同时,优化选择合适的检测波长是有用的。
响应和校正因子的定义
如文献[4]中论及,“响应因子”和“校正因子”表达的含义通常以不同的方式处理。根据欧洲药典[5],响应因子(或相对响应因子relative response factor,RRF)表示指定物质相对于标准物质的检测器灵敏度,即相同浓度下杂质的检测器响应与供试品的检测器响应的比例。专论中给出的校正因子是响应因子的倒数,供试液采集得到的色谱图中杂质峰面积必须乘以该校正因子。通常,响应因子使用以下表达式来计算:
RRF=(Ai/As)×(Cs/Ci)
RRF:响应因子;
Ai:杂质峰面积;
As:供试品的峰面积;
Cs:供试品的浓度,mg/ml;
Ci:杂质的浓度,mg/ml
为了进行计算,可以使用整个线性范围内的峰面积比的平均值,或者使用杂质和供试品的线性回归方程的斜率比值。
在欧洲药典的技术指南中还讨论了响应和校正因子的含义及正确的使用方法[6]。根据通则2.2.46色谱分离技术与指南,当杂质与供试品的响应值之比落在0.8~1.2范围之外,必须对杂质峰面积进行校正,即在0.8~1.2范围内不考虑响应值的差异。因此,在所有情况下,对于特定杂质,在专论的验证过程中检测到超出该范围的响应因子,即校正因子也在该范围之外,则在专论的有关物质部分中说明相应的校正因子。
然而,没有提供关于如何确定响应和校正因子的指南。
响应因子的确定
响应因子可以通过制备一定浓度的杂质溶液和供试品溶液,在指定波长和流速下对这些溶液进行色谱分析,然后使用上述公式对峰面积进行比较来确定。理想情况下,杂质的浓度和供试品的浓度应在同一数量级上,并且应在杂质的接受标准浓度附近,测定的多点校正曲线进行计算。
然而,不仅要称量相应量的杂质和供试品比较峰面积,非常重要的是,还要针对所测试物质的纯度进行校正。理想情况下,应测定杂质和供试品的色谱纯度、水分和残留溶剂的量。含量将根据以下公式计算,该公式将遵循对照品赋值时相同的程序[3]:
含量(%)=[100-(水分+残留溶剂)]×色谱纯度百分比/100
上述提到的公式中Cs和Ci将根据杂质和供试品的含量进行校正:
RRF=(Ai/As)×(Cs×Ps/Ci×Pi)
RRF:响应因子;
Ai:杂质峰面积;
As:供试品的峰面积;
Cs:供试品的浓度,mg/ml;
Ps:供试品的含量,%;
Ci:杂质的浓度,mg/ml;
Pi:杂质的含量,%
由于响应因子的测定是方法验证的一部分,因此应在至少2个实验室进行验证,最好使用相同的方案,以便获得可比的结果。
测定中的一个限制因素通常是可用杂质的量。虽然希望以确定作为外标的杂质标准品相同的方式测定杂质的含量/纯度,但可用的量通常很少。于是,分析人员可自行选择消耗少量物质的方法,如用于测定水和/或溶剂的热重法或库仑法,以便仍能获得科学有效的结果。使用不同类型的检测器来确定响应因子也是有益的。
分析人员需要考虑的另一个重要问题是测定响应因子时杂质和供试品的形式(碱/酸或盐)。只要两者以相同的形式存在,即碱/碱或盐/盐,就可以这样使用样品的称重量,但如果存在差异,则应在计算中引入分子质量比的附加校正因子(折算系数)。
例如,如果专论物质是碱,而杂质是酒石酸盐(即具有相当大分子质量的反离子),则应将所称杂质量乘以校正因子M盐/M碱,并针对分子质量的差异进行校正。
确定和使用响应因子的限制和特定方面
不同吸收峰
理想情况下,杂质和供试品的最大吸收波长应相差不大,以便在任意物质的最大吸收或附近指定波长测定响应值。当杂质和供试品的吸收曲线相差很大时,可在供试品最大值处测量响应,但对于杂质,可能在吸收曲线的坡上测量。如图1所示,在一条吸收曲线的最大值处测量意味着在第二条曲线的陡峭部分同时测量。因此,波长测量精度的微小变化可能会对杂质测定的吸光度产生强烈影响,而供试品测定的吸光度几乎没有变化。
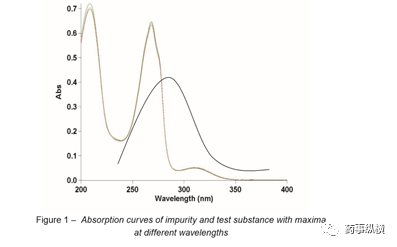
在这方面,要提及通则2.2.25.紫外和可见吸收分光光度法[7]描述了波长校验的允许公差,而2.2.29.液相色谱法包含一段关于检测器的内容,但是没有描述对波长或吸光度的控制。
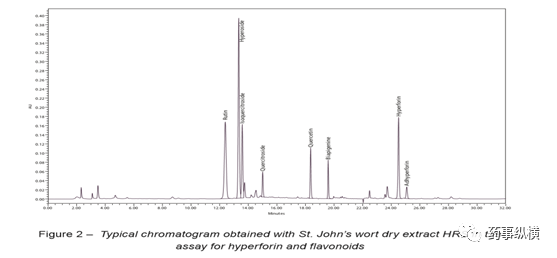
在贯叶金丝桃提取物(St. John’s Wort dry extract, quantified)[8]专论中可以找到这个问题的解决方法。在这篇专论中,贯叶金丝桃素的含量是用液相色谱法以指定含量的芸香苷三水合物标准品(即芦丁)作为含量标准品测定的。为此,有必要描述贯叶金丝桃素相对于芦丁的校正因子。贯叶金丝桃素在275nm处有最大吸收,芦丁的紫外吸收曲线表现为陡峭的吸收曲线,即上述情况。
因此,校正系数是通过测量两种不同波长下的响应来确定的,芦丁为360 nm,贯叶金丝桃素为275 nm,在色谱运行期间(22分钟),波长从360nm切换到275nm,以便在360nm处检测到芦丁和一些黄酮类化合物,在275nm处检测到晚洗脱的贯叶金丝桃素和贯叶连翘素(图2)。
杂质响应低
当杂质的响应远低于供试品的响应时,观察到一个特殊的问题,即杂质峰的面积必须乘以明显大于1的校正因子。在这种情况下,可能会出现特定杂质存在在高于报告阈值(忽略限,通常为0.05%)的水平,但由于响应较低,相应的峰明显低于该极限,因此当在应用校正因子之前应用报告阈值时,会忽略该峰。
例如,校正因子为10的杂质可能以0.2%的水平存在,但被错误地忽略,因为在乘以校正因子之前,对应的峰仅出现在0.02%的水平,即低于通常的报告阈值0.05%。
因此,在应用报告阈值之前,必须将峰面积乘以校正因子。可在专论中设计灵敏度试验。为此,可以假设配制杂质的标准溶液,其浓度相当于杂质忽略限,并且要求最小信噪比(S/N)为10,相当于所得峰的定量限。如果使用自身对照溶液进行定量,则在相当于报告阈值的浓度下使用自身对照溶液获得的峰的S/N应至少为校正因子的10倍(例如校正因子为4,则S/N要求应至少为40)。在灵敏度足够好且杂质峰在报告阈值处的S/N值远远大于10的情况下,可能不需要进行该试验。
响应/校正因子的使用限制
如上所述,需要高校正因子的低响应杂质,定量限可能会高于杂质的报告阈值。在这种情况下,应选择不同的检测波长。通常,当使用高校正因子时,定量测定的准确度降低,因为多次注入标准溶液或供试溶液的峰面积重复性对于小峰不如对于大峰好。因此,校正因子越高,测定的不确定度就越大。对于响应因子高的杂质,即校正因子低于1,则不会出现此问题。
因此,《欧洲药典技术指南》[6]建议响应因子的下限为0.2。低于此值时,应考虑使用杂质外标或在不同检测波长下进行测量。
结论
当有关杂质的量足以用外标法时,且响应因子在0.8至1.2范围之外时,使用响应因子和校正因子通过液相色谱法测定杂质是一种有价值的方法。必须特别注意正确测定响应因子,以获得样品中杂质含量测定的可靠结果。这种方法的限制条件是杂质的响应因子非常低,最大吸收与待测物质相差很大。本文举例说明如何解决这些问题。
参考文献
[1] Liquid chromatography, general chapter 2.2.29.Ph. Eur. 8th Edition. Strasbourg, France: Council of Europe; 2013.
[2] Control of impurities in substances forpharmaceutical use, general chapter 5.10. Ph. Eur. 8th Edition. Strasbourg,France: Council of Europe; 2013.
© Pharmeuropa | Useful information | August 2015 7
[3] Reference standards, general chapter 5.12. Ph.Eur. 8th Edition. Strasbourg, France: Council of Europe; 2013.
[4] Bhattacharyya L, Pappa H, Russo KA et al. Theuse of relative response factors to determine impurities. Pharmacopeial Forum 2005; 31(3):960-6.
[5] Chromatographic separation techniques, general chapter 2.2.46. Ph. Eur. 8th Edition. Strasbourg, France: Council of Europe;2013.
[6] Technical guide for the elaboration ofmonographs, 7th Edition. Strasbourg, France: Council of Europe; 2015.
[7] Absorption spectrophotometry, ultraviolet andvisible, general chapter 2.2.25. Ph. Eur. 8th Edition. Strasbourg, France:Council of Europe; 2013.
[8] St. John’s Wort dry extract, quantified,monograph 1874. Ph. Eur. 8th Edition. Strasbourg, France: Council of Europe;2013.
注:本文来源至“药事纵横 ”;不用于任何商业用途。我们尊重原创作品。选取的文章已明确注明来源和作者,版权归原作者所有,如涉及侵权或其他问题,请联系我们进行删除。

